4月6日,阿斯利康和第一三共共同宣布Enhertu(德曲妥珠单抗)已获美国FDA加速批准,用于治疗既往接受过全身治疗且没有令人满意的替代治疗方案的不可切除或转移性HER2阳性(IHC 3+)实体瘤成人患者。

德曲妥珠单抗是一款靶向HER2的抗体药物偶联物(ADC),采用第一三共专有的DXd ADC技术设计,由HER2单抗通过稳定的四肽可裂解连接子连接于拓扑异构酶I抑制剂有效载荷(依沙替康衍生物)上。该产品全球由第一三共和阿斯利康联合开发推广,同时第一三共拥有该产品在日本独家商业化权益。
FDA基于DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02试验中HER2阳性IHC 3+亚组肿瘤患者的客观反应率(ORR)和缓解持续时间(DoR)加速批准该项适应症,其完全批准将取决于验证性试验中临床获益的验证和描述。
DESTINY-PanTumor02研究是一项全球性、多中心、开放标签、多队列的II期临床试验,旨在评估Enhertu(5.4mg/kg)在接受过治疗的局部晚期、不可切除或转移性的表达HER2实体瘤患者中的疗效和安全性,包括胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌或其他肿瘤。
该研究的主要终点是由研究者评估确认的客观缓解率(ORR),次要终点包括缓解持续时间(DoR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)、安全性、耐受性和药代动力学。共在亚洲、欧洲和北美洲的多家研究中心入组了267例患者。
截至2023年06月08日,中位随访时间为12.75个月。结果显示,德曲妥珠单抗在既往接受过治疗的HER2表达晚期实体瘤患者(n=267)总研究人群中经研究者评估确认的ORR为37.1%(95%[CI]:31.3-43.2),中位DoR为11.3个月(95%CI:9.6-17.8),中位PFS为6.9个月(95%CI:5.6-8.0),中位OS为13.4个月(95%CI:11.9-15.5)。
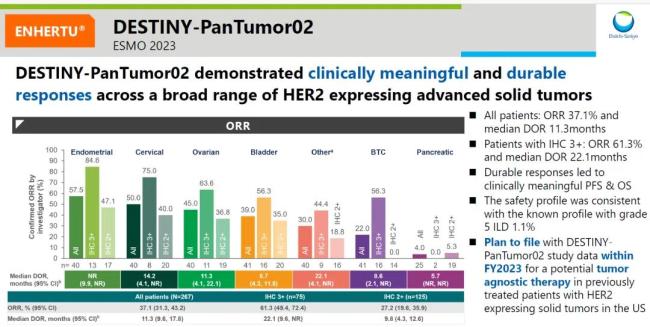
探索性分析结果显示,经中心实验室检测确认肿瘤HER2表达即免疫组化(IHC)3+(n=75)的患者表现出最高的缓解率,确认的ORR为61.3%(95%CI:49.4-72.4),中位DoR为22.1个月(95%CI:9.6-NR),中位PFS为11.9个月(95%CI:8.2-13.0),中位OS为21.1个月(95%CI:15.3-29.6)。
最新数据显示,DESTINY-PanTumor02总研究人群ORR为51.4%,中位持续缓解时间为19.4个月。
在DESTINY-Breast01、DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02试验中,对347例不可切除或转移性HER2阳性(IHC 3+)实体瘤患者进行了Enhertu的安全性评估。整个试验中观察到的安全性与Enhertu之前的临床试验一致,没有发现新的安全性问题。基于这些结果,Enhertu已被纳入NCCN肿瘤学临床实践指南(NCCN指南®),作为多发性转移性肿瘤的治疗选择。
由于国内投融资和订单情况在下滑,CXO整体难以快速恢复景气,但局部细分领域依然蕴含着较多机会。想要顺利穿越寒冬,企业必须在修炼内功的同时,又能跟得上变化。
金斯瑞旗下传奇生物西达基奥仑赛成为首个且唯一获FDA批准用于多发性骨髓瘤二线治疗的BCMA CAR-T产品。
行业媒体BioPharma Dive总结FDA2024年第二季度值得关注的5项审批决定,反映当前的行业最新动向。
美国国会议员声称,中国基因组学巨头华大基因(BGI)在美国设立子公司试图逃避监管和政治审查,并在一封信中敦促将这些子公司列入五角大楼声称的与中国军方合作的公司名单。
又是一年金“三”,有药企在失序中试图通过管理层换血“革新”;有药企则试图通过设立新的组织架构和高管任命,找寻新机会。
根据全球临床试验收录网站clinicaltrials和中国临床试验登记平台chinadrugtrials,3月共12款创新药进入III期阶段,其中5款来自中国药企。