12月4日,中国国家药监局药品审评中心官网公示,贝达药业从C4 Therapeutics(C4T)引进的1类新药CFT8919片已获得临床试验默示许可,拟开发用于治疗携带EGFR突变的局晚期或晚期非小细胞肺癌(NSCLC)患者。

截图来源:CDE官网
今年5月,贝达药业达成一项近4亿美元的合作,获得了CFT8919在大中华区开发、制造和商业化的权益。
今年7月,C4T收到了美国食品药品监督管理局签发的《药物临床试验批准通知书》,允许CFT8919片在美国开展Ⅰ/Ⅱ期临床试验。CFT8919片是一种具有口服生物利用度的变构BiDAC™降解剂,对携带EGFR外显子21(L858R)突变具有良好的活性和选择性,同时对T790M或C797S突变的EGFR继发耐药突变有效。

△CFT8919作用机理图(来源:C4T)
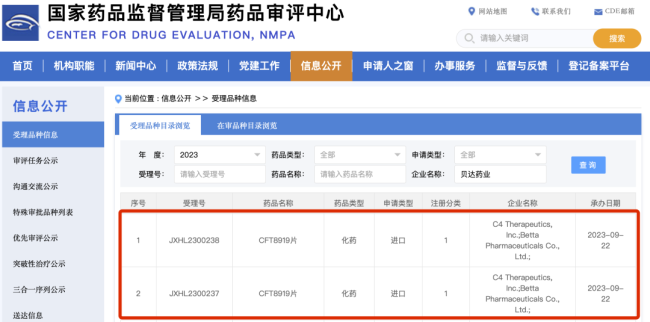
今年9月,贝达药业收到国家药品监督管理局签发的《受理通知书》(受理号:JXHL2300237、JXHL2300238),公司从C4 Therapeutics(C4T)引进的CFT8919片携带EGFR突变的非小细胞肺癌患者适应症临床试验申请获国家药品监督管理局受理。
多个大型随机对照试验亚组分析结果显示,一代、二代和三代EGFR-TKI治疗19del和21L858R突变患者显示出了不同的疗效,总体来看,19del突变患者的获益要明显高于21L858R突变的患者。对于携带21L858R突变NSCLC患者,临床上仍存在较大的未满足需求,期待更好的治疗方案。
贝达药业董事长丁列明曾表示,CFT8919片是公司在靶向蛋白降解领域的一次探索,公司已有一代、三代EGFR-TKIs上市产品,以及四代EGFR-TKIs、EGFR/cMET双抗产品管线,在EGFR突变的非小细胞肺癌领域积累了丰富的经验,为助力CFT8919片后续研发奠定了坚实基础。亚洲EGFR L858R突变患病人群较多,存在较大的未被满足的临床用药需求。期待CFT8919片早日开展临床研究,为全球患者提供新的治疗选择。
减肥药概念股翰宇药业11月6日再度大涨,其公告表示年内收获第二笔出口大单。尽管从目前公布的财报看,今年前三季度公司业绩很差,但市场仍然认为其具有反转的能力。
在“二元协同重塑产业—开启个人健康主体责任新时代”的背景下,中康团队作出了最新的九大产业趋势研判。
2023年已经即将步入末期,必贝特的注册结果仍然还未生效。快速过会的必贝特为何却迟迟没能等来注册的最新进展?